BNC2 e o Poder da Saciedade: Nova Descoberta de Neurônios que Suprimem o Apetite Rapidamente
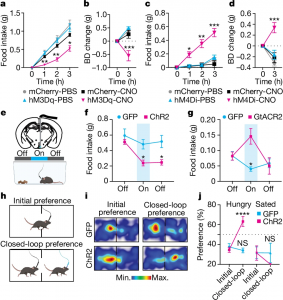
Legenda: a,b, Ingestão horária de alimento (a) e variação de peso corporal (BD) em 3 horas (b) em camundongos machos que receberam injeção de PBS ou CNO no início da fase escura noturna (n = 5 camundongos injetados com mCherry, n = 4 camundongos injetados com hM3Dq; ANOVA de duas vias). c,d, Ingestão horária de alimento (c) e variação de peso corporal em 3 horas (d) em camundongos machos que receberam injeção de PBS ou CNO durante o período diurno (n = 6 camundongos injetados com mCherry, n = 8 camundongos injetados com hM4Di; ANOVA de duas vias). e, Injeção unilateral do vírus AAV na região ARC de camundongos machos adultos BNC2-Cre, seguida do implante de fibra óptica. f, Ingestão de alimento antes, durante e após a estimulação com laser em camundongos submetidos a jejum durante a noite (n = 7 camundongos injetados com GFP, n = 12 camundongos injetados com ChR2; ANOVA de duas vias). g, Ingestão de alimento antes, durante e após a estimulação com laser em camundongos alimentados ad libitum durante o período diurno (n = 7 camundongos injetados com GFP, n = 5 camundongos injetados com GtACR2; ANOVA de duas vias). h–j, Teste de preferência de lugar com circuito fechado (h,i) para avaliar a valência dos neurônios BNC2. i, Mapas de calor representativos do tempo gasto em cada câmara por camundongos machos adultos BNC2-Cre em jejum noturno, injetados com GFP ou ChR2, durante a fase inicial e a fase emparelhada com o circuito fechado. j, Quantificação da preferência de lugar (tempo gasto na câmara emparelhada com a estimulação, n = 6 camundongos injetados com GFP, n = 8 camundongos injetados com ChR2; ANOVA de duas vias).Os dados são apresentados como média ± erro padrão da média (s.e.m.). NS, não significativo; *P < 0,05; **P < 0,01; ***P < 0,001; ****P < 0,0001. Detalhes estatísticos estão disponíveis nos Dados Fonte. As ilustrações em e e h foram criadas usando o BioRender.
Creditos da imagem: Tan et al, 2024
Pesquisadores identificaram um novo grupo de neurônios no hipotálamo, conhecidos como neurônios BNC2, que desempenham um papel crucial na supressão rápida do apetite. Publicado na Nature, o estudo revela que esses neurônios são diretamente ativados pelo hormônio leptina, produzido pelo tecido adiposo, sendo fundamentais para manter o equilíbrio energético e a saciedade. Até então, acreditava-se que a leptina atuava principalmente inibindo os neurônios AGRP (estimuladores do apetite) e ativando os neurônios POMC (supressores do apetite). No entanto, enquanto os neurônios AGRP rapidamente promovem a fome, a ativação aguda dos neurônios POMC tem impacto limitado.
Os neurônios BNC2 preenchem essa lacuna, agindo como um mecanismo rápido de supressão da fome ao inibir diretamente os neurônios AGRP, responsáveis pelo estímulo à alimentação. O estudo demonstra que, quando ativados, os neurônios BNC2 não apenas reduzem drasticamente a ingestão de alimentos, mas também melhoram a regulação da glicose no sangue e aumentam a sensibilidade à insulina, sugerindo um papel mais amplo no metabolismo energético. Por outro lado, a deleção do receptor de leptina (LepR) nos neurônios BNC2 resulta em hiperfagia (consumo excessivo de alimentos), obesidade e alterações metabólicas, como intolerância à glicose e resistência à insulina.
Além disso, os neurônios BNC2 respondem de maneira rápida e precisa a sinais sensoriais relacionados à presença de alimentos, como cheiro e paladar, sendo ainda mais ativados por alimentos mais palatáveis. Esse mecanismo dinâmico e adaptativo sugere que os neurônios BNC2 atuam como um detector de coincidências entre os níveis de leptina e os estímulos sensoriais, garantindo um controle eficiente da fome em resposta ao estado nutricional e ao ambiente.
Esta descoberta representa um avanço significativo na compreensão dos circuitos neurais envolvidos no controle do apetite, fornecendo novas perspectivas para o desenvolvimento de estratégias terapêuticas contra a obesidade e distúrbios metabólicos. A ativação farmacológica dos neurônios BNC2 pode oferecer um caminho promissor para reduzir o peso corporal e neutralizar os efeitos negativos da fome, com potencial impacto clínico relevante.
Leptin-activated hypothalamic BNC2 neurons acutely suppress food intake
Leptin-activated hypothalamic BNC2 neurons acutely suppress food intake